一、双酶切构建载体方法
首先,对引物的设计有着严格的要求,引物的长度一般为18-25bp,GC含量控制在40%-60%,上、下游引物之间GC含量不能相差太大,引物中需要加入酶切位点及保护性碱基。引物设计不当可能在扩增时生成引物二聚体,给实验带来不便。
其次,目的基因有必要进行TA克隆。在后续的实验操作中,可能会由于酶切效率和连接效率低等原因使得载体构建相当困难,目的基因扩增在这些步骤之前,由于PCR扩增是体外扩增,很容易发生突变,TA克隆有着成功率高的优点,通过TA克隆将目的基因构建进pMD19T进而转化入大肠杆菌中,单克隆菌体自身的修复机制可保证单一的克隆,利于筛选需要的序列,通过后续测序鉴定可以得到大量正确的目的基因片段,而且直接将PCR产物切下来不易产生粘性末端,连接入表达载体比较困难,通过TA克隆酶切的目的片段产生粘性末端的概率很高。
第三,双酶切效率不高。由于不同的酶所对应的缓冲液不同,内切酶只有在缓冲液环境下效率才能得到优化,但是双酶切体系势必使其中一个酶的活性有所损失。这样必定会使酶切产物不纯。酶切产物中既有单酶切线性载体,也有双酶切线性载体,使得连接时所需要的双酶切线性载体的量失准,影响连接效率。因此可以先用一个控制性内切酶切割纯化回收,但工作量较大,回收率低。
第四,连接效率低。pMIR reporter与目的片段的摩尔比很重要,一般在3:1-10:1间浮动,而且连接效率和连接反应体积也有关系。
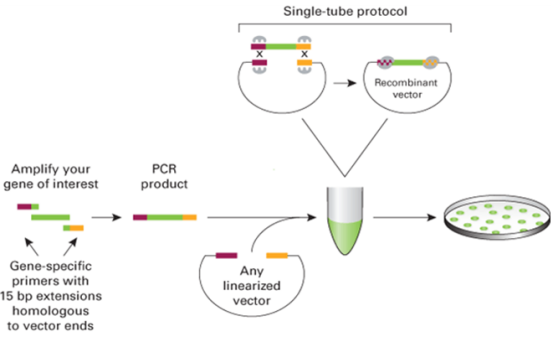
二、同源重组法构建载体
采用同源重组法构建载体与常规双酶切构建载体方法不同。首先,设计引物时上游引物5’端前面加的是酶切位点(如 Hind III)及该酶切位点在pMIR reporter载体中对应前面的15个碱基载体片段,下游引物5’端前面加的是HindIII酶切位点及该酶切位点在pMIR reporter载体中对应后面的15个碱基载体片段,如此设计引物是为了保证目的片段插入载体时方向正确。其次,载体只需要单酶切,用Hind III酶切pMIR reporter,使得pMIR reporter成为两端都带着Hind III位点的线性载体。相比双酶切切割载体,单酶切可以保证酶切后的载体都是单一的线性片段,使得后续的重组连接更准确。第三,省去了TA克隆环节。因为PCR产物可以直接用于重组连接,不需要酶切产生粘性末端,而且重组酶的重组能力强于T4DNA连接酶的连接能力,一般只需要一步即可重组连接成功,因此可以在重组反应之后进行测序鉴定。